Dal 27 dicembre 2020 al 26 agosto 2021 sono state inserite 119 segnalazioni ogni 100.000 dosi somministrate, indipendentemente dal vaccino e dalla dose somministrata: per l’86,1% si tratta di eventi avversi non gravi che si risolvono completamente, 13,8% classificati come gravi, con esito in risoluzione completa o miglioramento nella maggior parte dei casi.
Sono alcuni dei dati salienti che emergono dall’ultimo rapporto sulla sorveglianza dei vaccini Covid-19 pubblicato dall’Aifa, che sottolinea come per tutti i vaccini, gli eventi avversi più segnalati siano febbre, stanchezza, cefalea, dolori muscolari/articolari, reazione locale o dolore in sede di iniezione, brividi e nausea.
Il tasso di segnalazione della vaccinazione con schedula mista è di 41 segnalazioni ogni 100.000 dosi somministrate, la maggior parte non grave e con esito in risoluzione completa o miglioramento. La distribuzione per tipologia degli eventi avversi non è sostanzialmente diversa fra i due vaccini utilizzati.
Il tasso di segnalazione nella fascia di età tra i 12 e i 19 anni è di 22 eventi avversi ogni 100.000 dosi somministrate. La distribuzione per tipologia degli eventi avversi non è sostanzialmente diversa da quella osservata per tutte le altre classi di età.
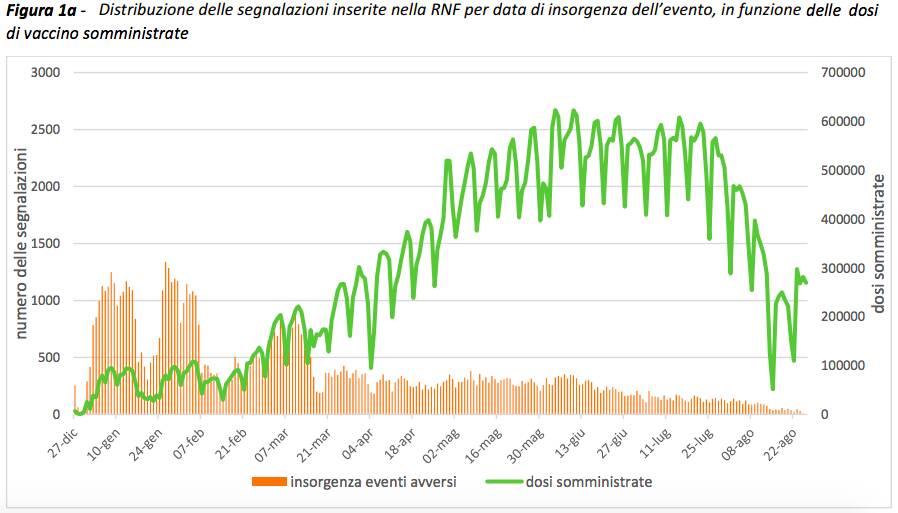
Nel periodo preso in esame, sono 91.360 le segnalazioni di sospette reazioni avverse su 76.509.846 dosi somministrate.
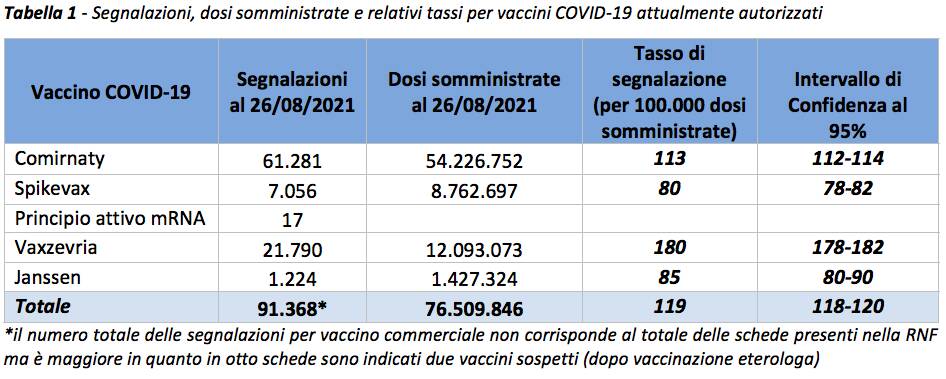
L’andamento nel tempo delle segnalazioni rispetto alle dosi somministrate (figura 1a) e al numero di dose per tutti i vaccini è sovrapponibile a quello riportato nei precedenti Rapporti, con un minore incremento delle segnalazioni rispetto all’aumento del numero di somministrazioni, anch’esse in calo nel mese di agosto, ed è stabile negli ultimi mesi. Si ricorda che tale andamento è una fotografia delle segnalazioni presenti nella Rete Nazionale di Farmacovigilanza al momento dell’estrazione dei dati e può modificarsi nel tempo.
L’età media delle persone che hanno avuto un sospetto evento avverso è 48,3 anni (età mediana di 48 anni).
Come già riportato negli studi clinici pre-autorizzativi e nei precedenti Rapporti, il tasso di segnalazione è maggiore nelle fasce di età comprese tra i 20 e i 60 anni, per poi diminuire nelle fasce d’età più avanzate e nei giovanissimi, con un andamento simile dopo 1a e 2a dose.
Circa il 72% delle segnalazioni proviene da operatori sanitari, prevalentemente medici e farmacisti, mentre circa il 27% da paziente/cittadino, con un modesto incremento rispetto ai mesi precedenti. Il 96% circa di queste segnalazioni è di tipo spontaneo.
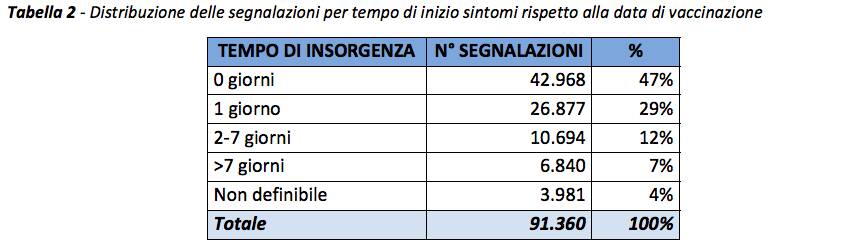
Come riportato nei precedenti Rapporti, indipendentemente dal vaccino, dalla dose e dalla tipologia di evento, la reazione si è verificata nella maggior parte dei casi (80% circa) nella stessa giornata della vaccinazione o il giorno successivo e solo più raramente l’evento si è verificato oltre le 48 ore successive.
Distribuzione per gravità ed esito
La gravità delle segnalazioni viene definita in base di criteri standardizzati che non sempre coincidono con la reale gravità clinica dell’evento. Un evento è sempre grave se causa ospedalizzazione, pronto soccorso, pericolo immediato di vita, invalidità, anomalie congenite, decesso, altra condizione clinicamente rilevante. Alcuni eventi avversi, inoltre, vengono considerati sempre gravi se presenti in una lista pubblicata e periodicamente aggiornata dall’Agenzia Europea dei Medicinali, sotto il nome di IME list (Important Medical Events, per es. febbre alta).
L’86,1% delle segnalazioni inserite al 26/08/2021 è riferita a eventi non gravi, con un tasso di segnalazione pari a 103/100.000 dosi somministrate e il 13,8% a eventi avversi gravi, con un tasso di 13 eventi gravi ogni 100.000 dosi somministrate, indipendentemente dal tipo di vaccino, dalla dose somministrata (1a o 2a dose) e dal possibile ruolo causale della vaccinazione (la gravità non è riportata nello 0,1% delle segnalazioni).
I tassi di segnalazione degli eventi avversi gravi per i singoli vaccini sono: 13 casi ogni 100.000 dosi di Comirnaty, 14 ogni 100.000 dosi di Spikevax, 33 ogni 100.000 dosi di Vaxzevria e 19 ogni 100.000 dosi di Janssen.
Come già riportato nei precedenti Rapporti, anche gli eventi avversi gravi segnalati si verificano soprattutto nelle prime 48 ore dopo la vaccinazione (circa il 53% dei casi), mentre più raramente si osservano nelle settimane successive (circa il 41% dei casi). Nel restante 6% dei casi, le informazioni sono insufficienti a stabilire il tempo di insorgenza dell’evento avverso rispetto alla segnalazione, nonostante le richieste di follow up effettuate.
La maggior parte delle segnalazioni gravi sono classificate come “altra condizione clinicamente rilevante”, ovvero hanno allertato il soggetto e/o il segnalatore senza determinare un intervento specifico in ambiente ospedaliero.
Al momento della stesura del Rapporto, il nesso di causalità secondo l’algoritmo dell’OMS è stato inserito nel 74% (9.324/12.600) delle segnalazioni di eventi avversi gravi, indipendentemente dall’esito ed è risultato correlabile alla vaccinazione nel 42% di tutte le segnalazioni gravi valutate (3.909/9.324), indeterminato nel 35% (3.302/9.324) e non correlabile nel 20% (1.845/9.324). Il 3% (268/9.324) delle segnalazioni valutate è inclassificabile, per mancanza di informazioni sufficienti.
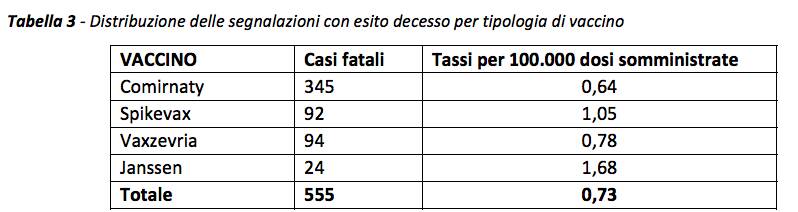
Complessivamente, 555 di queste segnalazioni gravi (al netto dei duplicati, ovvero dei casi per cui è stata inserita più di una segnalazione) riportano l’esito “decesso” con un tasso di segnalazione di 0,73/100.000 dosi somministrate, indipendentemente dalla tipologia di vaccino, dal numero di dose e dal nesso di causalità, tasso simile a quello riportato nel Rapporto precedente.
La distribuzione di questi casi ad esito fatale per tipologia di vaccino è riportata nella tabella sottostante.
Il 48,5% dei casi riguarda donne, il 50,8% uomini mentre lo 0,7% (4 schede) non riporta questo dato. L’età media è di 76 anni (range 18-104 anni). Il tempo intercorrente tra la somministrazione e il decesso varia da due ore fino a un massimo di 133 giorni, ove riportato. In 381 casi il decesso è registrato dopo la prima dose e in 174 dopo la seconda. Continuano a non essere segnalati decessi a seguito di shock anafilattico o reazioni allergiche importanti, mentre è frequente che il decesso si verifichi a seguito di complicanze di malattie o condizioni già presenti prima della vaccinazione.
Il 71,3% (396/555) delle segnalazioni con esito decesso presenta una valutazione del nesso di causalità con l’algoritmo dell’OMS, in base al quale il 58.8% dei casi (233/396) è non correlabile, il 32,3% (128/396) indeterminato e il 5,3% (21/396) inclassificabile per mancanza di informazioni sufficienti. Complessivamente, 14 casi (3,5%) sui 396 valutati sono risultati correlabili (circa 0,2 casi ogni milione di dosi somministrate), di cui 7 già descritti nei Rapporti precedenti.
Le rimanenti 7 segnalazioni si riferiscono a 3 pazienti ultraottantenni con condizione di fragilità per pluripatologie, deceduti per COVID-19 dopo aver completato il ciclo vaccinale (in due casi 3 settimane prima e in un caso 39 giorni prima dell’evento fatale), 3 pazienti deceduti per complicanze di un evento di natura trombotica associato a trombocitopenia e 1 paziente deceduto per complicanze di porpora trombotica trombocitopenica.
Vaccino Comirnaty (Pfizer/BioNTech)
L’analisi della distribuzione per tipologia degli eventi avversi a seguito di vaccinazione con Comirnaty non ha osservato sostanziali differenze rispetto ai precedenti Rapporti. Le sospette reazioni avverse più frequentemente segnalate rientrano nelle patologie generali e condizioni relative alla sede di somministrazione, soprattutto reazioni nel sito di inoculazione, febbre e stanchezza/astenia, seguite dalle patologie del sistema nervoso, prevalentemente cefalea e parestesie, dalle patologie del sistema muscoloscheletrico e del tessuto connettivo, per la maggior parte dolore muscoloscheletrico e dalle patologie gastrointestinali, in genere nausea, vomito e diarrea.
Resta invariata la proporzione fra segnalazioni gravi (10% circa) e non gravi (89% circa). Nell’1% dei casi la gravità non è definita. La distribuzione per tipologia degli eventi avversi gravi non si discosta significativamente da quella di tutti gli eventi.
Eventi avversi gravi correlabili a Comirnaty
Circa 4 segnalazioni ogni 100.000 dosi somministrate di Comirnaty sono gravi correlabili alla vaccinazione (4 ogni 100.000 prime dosi e 3 ogni 100.000 seconde dosi). In base al criterio di gravità, il 74% sono state inserite come “gravi – altra condizione clinicamente rilevante”, il 20% come ospedalizzazione e il 3% come pericolo di vita. La risoluzione completa della reazione avversa è riportata come esito nel 54% di queste segnalazioni e il miglioramento nel 26%. L’iperpiressia si conferma l’evento avverso grave correlabile più comunemente segnalato (circa 1,5 casi ogni 100.000 dosi somministrate), seguito da dolori articolari e muscolari, cefalea e astenia, tutte con un tasso di circa 1 caso ogni 100.000 dosi somministrate. Questi sintomi sono molto spesso associati fra loro in un quadro di sindrome simil-influenzale, senza sostanziali differenze fra prima e seconda dose. Meno frequenti sono le reazioni ansiose alla vaccinazione (più spesso reazioni lipotimiche), le parestesie diffuse e le linfoadenopatie, ciascuna con una frequenza di circa 0,5 casi ogni 100.000 dosi somministrate. Molto rare sono le reazioni anafilattiche (3 casi ogni milione di dosi somministrate), la miocardite/pericardite (2 casi ogni milione di dosi somministrate) e le paralisi del facciale (1 caso ogni milione di dosi somministrate).
Spikevax (ex-COVID19 Vaccino Moderna)
La distribuzione per tipologia degli eventi avversi a seguito di vaccinazione con Spikevax è sovrapponibile a quella osservata nei precedenti Rapporti.
La maggior parte dei sospetti eventi avversi segnalati sono relativi alle patologie generali e condizioni relative alla sede di somministrazione, soprattutto febbre, dolore in sede di iniezione, stanchezza/astenia, seguiti dalle patologie del sistema nervoso, per la maggior parte cefalea, dalle patologie del sistema muscoloscheletrico e del tessuto connettivo, come mialgie, artralgie e dolore muscoloscheletrico, e dalle patologie della cute e del tessuto sottocutaneo, prevalentemente eritema, rossore e reazioni orticarioidi. Le reazioni non gravi rappresentano circa l’83% del totale delle segnalazioni e quelle gravi il 16% (nell’1% dei casi la gravità non è definita), in linea con quanto osservato nel precedente Rapporto. La distribuzione per tipologia degli eventi avversi gravi non si discosta significativamente da quella di tutti gli eventi.
Eventi avversi gravi correlabili a Spikevax
Circa 3 segnalazioni ogni 100.000 dosi somministrate di Spikevax sono gravi correlabili alla vaccinazione, senza differenze fra prima e seconda dose. In base al criterio di gravità, il 68% di queste segnalazioni sono state inserite come “gravi – altra condizione clinicamente rilevante”, il 23% come ospedalizzazione e il 5% come pericolo di vita. La risoluzione completa della reazione avversa è riportata come esito nel 44% di queste segnalazioni e il miglioramento nel 30%. L’evento avverso grave correlabile più comunemente segnalato è l’iperpiressia, con un tasso di segnalazione di circa 1,5 casi ogni 100.000 dosi somministrate, seguito da cefalea, dai dolori articolari e muscolari e dalle reazioni ansiose alla vaccinazione (soprattutto a tipo lipotimia o reazione vegetativa), tutte con un tasso di segnalazione di circa 1 caso ogni 100.000 dosi somministrate. Anche per il vaccino Spikevax, iperpiressia, dolori articolari e muscolari e cefalea si associano spesso fra loro in un quadro di sindrome simil-influenzale, senza sostanziali differenze fra prima e seconda dose. Più rare sono l’astenia e le linfoadenopatie con un tasso di circa 0,5 casi ogni 100.000 dosi somministrate. Molto rare sono le reazioni anafilattiche, con un tasso di segnalazione di circa 2 casi per milione di dosi somministrate e le miocarditi/pericarditi con un tasso di circa 1 caso ogni milione di dosi somministrate.
Vaccino Vaxzevria (AstraZeneca)
Anche per il vaccino Vaxzevria, la distribuzione dei sospetti eventi avversi successivi a vaccinazione è in linea con quella riportata nei precedenti Rapporti. Le sospette reazioni avverse più segnalate rientrano nella classe organo-sistemica delle patologie generali e condizioni relative alla sede di somministrazione (soprattutto febbre, reazioni locali nel sito di inoculazione e stanchezza/astenia), seguite dalle patologie del sistema nervoso, (prevalentemente cefalea) e dalle patologie del sistema muscoloscheletrico e del tessuto connettivo (per la maggior parte dolori muscoloscheletrici), spesso in associazione fra loro e con l’aumento della temperatura.
Circa l’81% delle segnalazioni al vaccino Vaxzevria è stato inserito come non grave e il 18% come grave (nell’1% dei casi la gravità non è definita).
Eventi avversi gravi correlabili a Vaxzevria
Sono state osservate circa 11 segnalazioni gravi correlabili ogni 100.000 dosi somministrate di Vaxzevria (11 ogni 100.000 prime dosi somministrate e 1 ogni 100.000 seconde dosi somministrate). Il 72% di queste segnalazioni sono gravi – altra condizione clinicamente rilevante, il 19% come ospedalizzazione e il 5,4% come pericolo di vita. La risoluzione completa della reazione avversa è riportata nel 44% di queste segnalazioni e il miglioramento nel 30%. Gli eventi avversi gravi correlabili più comunemente segnalati sono l’iperpiressia (7 casi ogni 100.000 dosi somministrate), seguita da cefalea e dolori articolari e muscolari, entrambi con un tasso di segnalazione di circa 4 casi ogni 100.000 dosi somministrate. Relativamente frequente è anche l’astenia, con un tasso di circa 2 casi ogni 100.000 dosi somministrate. Come per gli altri vaccini, questi sintomi sono spesso associati fra loro in un quadro di sindrome simil-influenzale che compare più frequentemente dopo la prima dose. Più raramente sono state segnalate lipotimie e reazioni vagali (1 caso ogni 100.000 dosi somministrate). Fra gli eventi avversi molto rari rientrano le neuropatie acute e subacute (fra cui la Sindrome di Guillain-Barré), le trombosi venose intracraniche o in sede atipica con piastrinopenia (VITT) e la trombocitopenia idiopatica, già oggetto di approfondimenti più ampi a livello europeo. Per tutte e tre queste reazioni avverse, si stima un tasso di segnalazione a livello nazionale di circa 1 caso ogni 1.000.000 di dosi somministrate. Il tasso di segnalazione per le reazioni anafilattiche è sovrapponibile a quello riportato nei precedenti Rapporti (2 casi ogni milione di dosi somministrate).
COVID-19 Vaccino Janssen
Rimane sovrapponibile ai precedenti Rapporti anche la distribuzione per tipologia dei sospetti eventi avversi successivi a vaccinazione con COVID-19 Vaccino Janssen, con la maggior parte delle segnalazioni che rientrano nelle patologie generali e condizioni relative alla sede di somministrazione, come febbre, reazioni locali in sede di iniezione e stanchezza/astenia, seguiti dalle patologie del sistema nervoso (prevalentemente cefalea) e dalle patologie del sistema muscolo-scheletrico e del tessuto connettivo (per la maggior parte mialgie e artralgie).
Il 78% delle segnalazioni al vaccino COVID-19 Vaccino Janssen è stato inserito come non grave e il 19% come grave (nell’1% dei casi la gravità non è stata definita), senza sostanziali differenze relative alla distribuzione per tipologia di reazione.
Eventi avversi gravi correlabili a COVID-19 Vaccino Janssen
Circa 4 segnalazioni ogni 100.000 dosi sono risultate gravi correlabili alla vaccinazione, il 48% delle quali inserite come gravi – altra condizione clinicamente rilevante, il 40% come ospedalizzazione e l’8% come pericolo di vita. La risoluzione completa della reazione avversa è riportata come esito nel 25% di queste segnalazioni e il miglioramento nel 42%. La numerosità delle segnalazioni gravi correlabili è tuttora molto bassa (27 segnalazioni), per il numero limitato di dosi attualmente somministrate. Pertanto, i tassi di segnalazione continuano a risentire della bassa esposizione, non si sono modificati rispetto al precedente Rapporto e non sono al momento consolidati. Nonostante ciò, la reazione avversa grave correlabile più frequentemente osservata è l’iperpiressia (circa 3 casi ogni 100.000 dosi somministrate), seguita dalle artromialgie diffuse (circa 2 casi ogni 100.000 dosi somministrate), frequentemente associate fra loro. Il numero di casi di trombosi venosa cerebrale o in sede atipica con piastrinopenia, di polineuropatie acute o subacute o di reazioni di tipo allergico grave è molto esiguo e comporta un tasso di segnalazione a livello nazionale inferiore a 1 caso ogni 1.000.000 di dosi somministrate.
Vaccinazione eterologa
Complessivamente, al 26/08/2021, sono state effettuate 604.865 vaccinazioni cosiddette eterologhe a persone al di sotto di 60 anni che avevano ricevuto il vaccino Vaxzevria come prima dose. Per completare il ciclo vaccinale è stato utilizzato il vaccino Comirnaty nel 76% dei casi e il vaccino Spikevax nel 24%.
Rispetto a tale modalità di vaccinazione con schedula mista, sono state inserite 248 segnalazioni con un tasso di segnalazione di 41 ogni 100.000 dosi somministrate. L’80% delle reazioni si è verificato con Comirnaty (43 segnalazioni ogni 100.000 dosi somministrate) e il 20% con Spikevax (33 segnalazioni ogni 100.000 dosi somministrate). Diversamente dalla distribuzione generale degli eventi avversi, il 51% circa delle segnalazioni proviene da cittadini e il 49% da operatori sanitari.
L’83% delle segnalazioni è riportato come non grave e il 17% come grave. L’esito risoluzione completa al momento della segnalazione è stato riportato nel 48% dei casi e il miglioramento nel 22% dei casi.
La distribuzione per tipologia degli eventi avversi non è sostanzialmente diversa fra i due vaccini utilizzati. In linea con le segnalazioni relative ai vaccini a mRNA, gli eventi avversi più frequentemente segnalati sono la febbre, le reazioni nel sito di inoculazione e i dolori articolari e muscolari diffusi. Più raramente sono state segnalate linfoadenopatia diffusa ed eruzioni cutanee generalizzate.
Vaccinazione nella fascia di età 12-19 anni
Alla data del 26/08/2021, sono stati utilizzati per la vaccinazione negli adolescenti i vaccini Comirnaty (la cui indicazione è stata estesa a partire dai 12 anni dal 31/05/2021) e Spikevax (approvato a partire dai 12 anni di età dal 28/07/2021), mentre i vaccini Vaxzevria e COVID-19 Vaccine Janssen sono autorizzati a partire dai 18 anni. Alla stessa data, sono state somministrate 3.798.938 dosi di vaccino in adolescenti di età compresa fra 12 e 19 anni, di cui il 77% di prime dosi e il 23% di seconde dosi. L’89,6% circa delle dosi utilizzate in questa fascia di età sono relative al vaccino Comirnaty, il 9% al vaccino Spikevax, lo 0,4% al vaccino Vaxzevria e l’1% al vaccino Janssen. Complessivamente, per la fascia di età 12-19 anni sono state inserite 838 segnalazioni di sospetto evento avverso con un tasso di segnalazione di 22 eventi avversi ogni 100.000 dosi somministrate (645 segnalazioni dopo la 1a dose, con un tasso di segnalazione di 26 eventi avversi ogni 100.000 dosi somministrate, e 193 segnalazioni dopo la 2a dose, con un tasso di segnalazione di 15 eventi avversi ogni 100.000 dosi somministrate). Il 76,5% circa delle segnalazioni è stato inserito come non grave e il 23,4% come grave (lo 0,1% delle segnalazioni non riporta questa informazione). Il 62% circa delle segnalazioni gravi riporta come esito al momento della segnalazione una risoluzione completa dell’evento o un miglioramento.
La distribuzione per tipologia degli eventi avversi non è sostanzialmente diversa da quella osservata per tutte le altre classi di età. In particolare, gli eventi avversi più frequentemente segnalati sono la cefalea, l’astenia, la febbre e le reazioni locali nel sito di inoculazione, indipendentemente dalla tipologia di vaccino, dal numero di dose e dalla gravità. Considerato il limitato numero di segnalazioni gravi ricevute (5 casi ogni 100.000 dosi somministrate), la valutazione della distribuzione per tipologia di evento e relativa valutazione del nesso causale risulta al momento ancora poco rappresentativa. Circa 1 segnalazione ogni 100.000 dosi somministrate è risultata grave correlabile alla vaccinazione, senza sostanziali differenze al momento rispetto al Rapporto precedente (frequentemente sindrome simil-influenzale, più raramente reazioni vaso-vagali e miocardite o pericardite).
Per segnalare una sospetta reazione avversa, si faccia riferimento al sito di Aifa.






commenta